| 10.4.1 Radioprotektiva s krátkodobým účinkem |
|
Mezi látky s krátkodobým účinkem řadíme:
Radioprotektivní látky obsahující síruRadioprotektiv obsahujících síru je celá řada. Mezi nejvýznamnější z hlediska radioprotektivních účinků řadíme:
Mechanizmus jejich účinku je dán inaktivací kyslíkových radikálů vznikajících při radiolýze vody -SH skupinou.
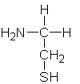
Již v roce 1949 byl popsán radioprotektivní účinek aminokyseliny cysteinu Pattem a jeho spolupracovníky. V roce 1951 objevila belgická skupina pod vedením Bacqa radioprotektivní účinky cysteaminu (merkaptoetylaminu) a cystaminu (dimerkaptoetylaminu).
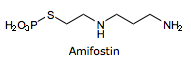
Za nejúčinnější preparát je považována látka označována kódem WR 2721 (podle Walter Reed Institute of Research, USA), která byla produktem rozsáhlého výzkumu zahájeného v roce 1959. V rámci tohoto programu bylo v letech 1959 až 1965 syntetizováno a testováno na 4 000 látek. Jedná se o S - 2 (3 - aminopropylamino) etylester kyseliny thiofosforečné, chemicky H2N - (CH2)3 - NH - CH2 - NH - (CH2)2 - S - PO3H 2. Radioprotektivní účinek WR 2721 byl prvně popsán v roce 1969. Preparát WR 2721 je znám v odborné literatuře pod různým názvem, nejčastěji v anglosaském názvosloví jako amifostine, v české literatuře jako amifostin (dříve gamafos, označení používané hlavně ruskými radiobiology).
S ohledem na výše uvedené řádky se proto zaměříme v dalším textu na možné praktické využití amifostinu a jeho metabolitů. Cytoprotektivní účinek amifostinu je dán především intracelulární koncentrací aktivního metabolitu WR-1065. Amifostin sám nevstupuje do buněk s ohledem na koncovou část jeho molekuly, která je tvořena kyselou fosfothiolovou skupinou. Při enzymatické aktivaci ale dochází pomocí alkalické fosfatázy k defosforylaci v oblasti této skupiny. Vzniklý defosforylovaný thiol WR-1065 již snadno pomocí pasivní difúze proniká do buněk. Právě potřeba enzymatické aktivace odpovídá za specificitu cytoprotektivního účinku amifostinu. Alkalická fosfatáza je, jako membránově vázaný enzym, přítomná ve vysoké koncentraci ve zdravých tkáních, především v endotelu krevních kapilár. Rovněž pH zdravých buněk a tkání je z hlediska optimální aktivity alkalické fosfatázy příznivé. Naopak nízká vaskularizace, hypoxie a nižší pH v nádorových tkáních neumožňují dostatečnou přeměnu amifostinu na jeho aktivní metabolity a jejich následný vstup do nádorových buněk, proto je také využíván v radioterapii. WR-1065 prostřednictvím volné sulfhydrylové skupiny (SH) rovněž působí v místech poškození DNA, kdy usnadňuje rychlou neenzymatickou reparaci poškození. Specifický transportní protein zajišťuje cílený transport WR-1065 na ta důležitá místa v jaderném chromatinu, která jsou rozhodující pro udržení integrity DNA a která je proto důležité chránit před účinkem.
Amifostin rozpuštěný ve vodě a podaný parenterálně se vstřebává poměrně rychle. Z plazmy je pravděpodobně eliminován rychlou konverzí na WR-1065, tato eliminace je však saturačně omezená. Vstup amifostinu do různých tkání je odlišný. Největší nahromadění jeho aktivity bylo zjištěno v kostní dřeni, slinných žlázách, střevní sliznici, játrech a v kůži, což koreluje s radioprotekcí v těchto tkáních. U těchto tkání se koncentrace látky zvyšuje po aplikaci rychle. Pomalé zvyšování koncentrace bylo zaznamenáno v srdci. Nízká akumulace byla stanovena v kosterním svalu, periferní krvi a prakticky žádná aktivita nebyla zaznamenána v mozku. WR-1065 je dále přeměněna intracelulárními redoxními reakcemi na disulfidickou sloučeninu WR-33278. WR-33278 se akumuluje především v jádře, kde se váže na nukleární proteiny a DNA a pravděpodobně se účastní řady intracelulárních pochodů, které mají vliv na stabilizaci chromatinu, syntézu DNA, aktivitu kinázových enzymů, expresi genů a tvorbu terciální a kvartérní struktury proteinů. Amifostin je účinné radioprotektivum s preferencí pro normální tkáně, především slinné žlázy, sliznice a kostní dřeň, které zabraňuje toxickým účinkům vyvolaným radioterapií, ale i chemoterapií, proto našel uplatnění také v klinické praxi. Amifostin selektivně chrání normální buňky, kdežto tumorózní ne. Radioprotektivní látka WR 2721 byla podrobně zkoumána v minulých létech na radiobiologickém pracovišti Vojenské lékařské akademie Jana Evangelisty Purkyně v Hradci Králové (dnes Fakulta vojenského zdravotnictví Univerzity obrany), kde výzkum této látky pokračuje do současnosti. Československo bylo jednou z mála zemí světa, která dokázala v chemických laboratořích VOZ Zemianské Kostoĺany (dnes Slovenská republika) pod vedením Ing. Cyrila Krajčoviče a prof. MUDr. Pavla Kuny, DrSc. tuto látku syntetizovat již koncem 70. let. Po intramuskulární aplikaci amifostinu je ochranné účinnosti dosaženo během 15 až 30 minut, zatímco po podání per os je nástup účinku za podstatně delší dobu a stupeň poskytované ochrany je nižší. K dosažení srovnatelného účinku je pro per os podání nutné zvýšit dávku přibližně třikrát a s ohledem na toxicitu je toto podání proto nevhodné. Doporučené dávkování amifostinu je nyní 2 mg/kg při intravenózním podání s DRF až 2,3. Výhodou injekčního podávání je možnost aplikace inaktivní formy, která po následné aktivaci alkalickou fosfatázou, přítomnou ve vysokých koncentracích v kapilárách a na povrchu buněk, probíhá extracelulárně a následně se aktivní forma dostává do nitra buněk pasivní difúzí. Nežádoucími účinky podávání amifostinu jsou nauzea, vomitus a hypotenze. Účinnost amifostinu při ochraně normálních tkání před radiačním poškozením při radioterapii byla sledována v řadě studií a následně vedla k jeho klinickému využití. Pro klinické studie je amifostin dodáván americkou firmou Shering - Plough pod názvem Ethyol inj. sicc.. V jedné lahvičce je 500 mg amifostinum suché substance. Využívá se nejvíce při radioterapii karcinomů v oblasti hlavy a krku s ohledem na jeho radioprotektivní účinek vzhledem ke slinným žlázám. Možnost aplikace je limitována jak toxicitou, tak i cenou preparátu. Jako radioprotektivum byl rovněž testován dihydrochlorid cystaminu (sovětské provenience) v tabletové formě obsahoval 0,2 g, později 0,4 g účinné látky. Pro jednorázové podání byla doporučována dávka 0,8 -1,2 g cystaminu přibližně 30 minut před předpokládaným ozařováním. Odhad DRF v oblasti postradiačního poškození krvetvorby u lidí byl 1,2. Nepříliš vysoká hodnota DRF a řada vedlejších účinků takto podávaného cystaminu (nauzea,zvracení, hypotenze, bradykardie) byl důvodem hledání jiného vhodného radioprotektiva.
Indolylalkylaminy
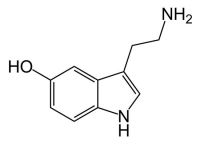
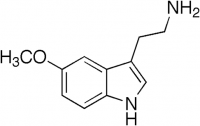
Indolylalkylaminy způsobují hypoxémii cestou vazokonstrikce. Navozením hypoxie snížíme množství kyslíku ve tkáních a následně i tvorbu kyslíkových radikálů v ozářených tkáních. V souvislosti s tímto mechanizmem byly testovány vybrané vasoaktivní látky. V tomto směru byly rozsáhlé studie věnovány především indolylalkylaminovým derivátům serotoninu (5-hydroxytryptaminu) a mexaminu (5-metoxytryptaminu). Jejich radioprotektivní účinek je vyvolán v savčím organizmu vasokonstrikční hypoxií v důsledku přímého účinku indolylalkylaminů na receptory buněk cévních stěn. Poněvadž byl popsán radioprotektivní účinek indolylalkylaminů i v pokusech s buňkami in vitro, lze uvažovat o jisté buněčné komponentě v mechanizmu jejich ochranného efektu. Tímto mechanizmem je možné dosáhnout DRF až 1,5. Nežádoucí se jeví hypoxické poškození periferních tkání, jako je tomu u varlat.
Serotonin.
Mexamin. Ve snaze zvýšit radiorezistenci savčího organizmu byly v experimentu zkoumány ochranné účinky kombinací radioprotektiv, především aminothiolů a indolylalkylaminů nebo cystaminu a mexaminu. Přesto, že byly analyzovány nejrůznější dvou i vícesložkové kombinace radioprotektivních látek, nepodařilo se touto cestou dosáhnout praktického použití u osob ohrožených akutním zevním ozářením. Jako nejúčinnější se ukázala kombinace fyzikálního stínění a radioprotektiva a to zejména neutronového záření.
Blokátory vápníkového kanálu
Mechanizmu navození intracelulární hypoxie využívá skupina látek označovaná jako blokátory vápníkového kanálu. Významným zástupcem je nifedipin s DRF přibližně 1,3. Avšak efektivní jsou opět dávky blížící se dávkám toxickým.
Nifedipin.
|