| 2.3.3 Oprava DNA |
|
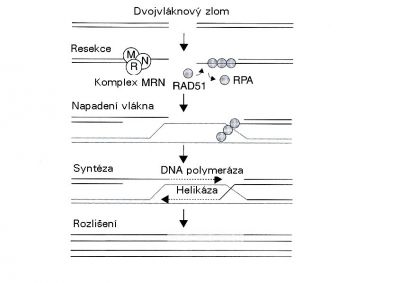
Dvojný zlom je nejen poškození, jehož rozpoznání je relativně dobře známo. Byl též jedním z nejstudovanějších ve smyslu opravy. Hlavní cesty byly podrobně popsány během posledních 10 či 15 let - homologní rekombinace (HR) a nehomologní připojení konců (non-homologous end-joining (NHEJ)). Jak lze odvodit z názvu, je homologní rekombinace proces, ve kterém se opravuje poškození úseku DNA s použitím informace o nepoškozeném homologním úseku DNA, obvykle na sesterském chromatidu. Protože dvojný zlom není téměř nikdy „čistým" zlomem dvou řetězců DNA, které mohou být jednoduše opět spojeny, je třeba konce na obou stranách nejprve připravit pro další postup. Výše zmíněný MRN komplex částečně natráví tyto konce a vytvoří a vytvoří spojení připomínající řetězce, které jsou potom potaženy speciálními proteiny. Tento komplex DNA-protein napadá homologní úsek DNA a nalézá příslušnou oblast pro čtení informace, která byla ztracena během zlomů a natrávení. Pro tento složitý krok se ovšem vyžaduje řada dalších proteinů, z nichž jeden je helikáza, enzym, který rozvíjí dvojitý řetězec. Poté DNA polymerázy kopírují potřebnou informaci ze dvou nepoškozených řetězců homologní DNA a vše se vrací ke svému normálnímu stavu pomocí dalších proteinů. Homologní rekombinace obvykle požaduje dostupnost sesterského chromatidu, a proto je možná pouze v (pozdních) S a G2 fázích buněčného cyklu. V G1 fázi by bylo v principu možno pro stejný účel použít informaci o homologním chromozomu, avšak zdá se, že to není příliš běžné. Proto většina buněk vykazuje vzrůstající radiorezistenci při postupu z G1 do S a dále během S-fází, s maximem v pozdní S-fázi. V G2 se stávají opět citlivějšími tak, jak je k dokončení opravy k dispozici stále méně času.
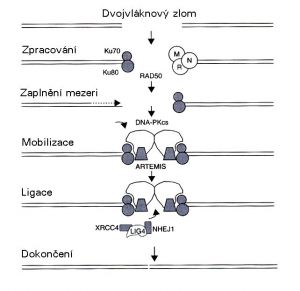
Oprava dvojných zlomů homologní rekombinací (RPA: replikační protein A) (modifikováno podle Joiner a van der Kogel (2009) obr. 2.7) Funkci alternativního mechanizmu, nehomologního připojování konců, lze objasnit z názvu. Konce dvojného zlomu se spojují dohromady přesto, že některá informace chybí bez zpětného návratu k homologní DNA. Dva proteiny, Ku70 a Ku80, se navazují na konce zlomu pro ochranu před dalším natrávením a mobilizují DNA-dependentní protein kinázu, což je velká molekula, která překlenuje mezeru mezi těmito volnými konci. Také spolupracuje s dalšími proteiny a částečně je aktivuje fosforylací. Tyto proteiny působí na zlom takovým způsobem, že jej mohou opět spojit. V mnoha případech to znamená vypuštění nebo vložení jednoho nebo několika párů bází. Tento proces proto není bez chyby, avšak je jednodušší a rychlejší než homologní rekombinace a je ve skutečnosti procesem, který lidské (a další savčí) buňky zřejmě převážně využívají pro opravu zlomu řetězce.
Oprava dvojných zlomů nehomologním spojením konců (modifikováno podle Joiner a van der Kogel (2009) obr. 2.8) Konečně se musíme zmínit o opravě jednoduchých zlomů a poškození bází. To, co mají společné, je intaktní templát DNA protějšího řetězce. Proto se jedná pouze o jeden řetězec, rozpoznání poškození, očištění místa a zaplnění mezery novými nukleotidy. V případě opravy jednoduchého zlomu rozpoznává poly-ADP-ribosová polymeráza poškození a modifikuje histony v daném místě. To vede k mobilizaci dalších enzymů, které vytvářejí mezeru s čistými konci v poškozeném řetězci DNA. V případě poškození báze je modifikovaná báze vyříznuta glykosylázou (tento postup se proto nazývá oprava excizí báze), což vede k vytvoření apurinového nebo apyrimidinového místa. Toto místo, samozřejmě rovněž pokud vzniká přímo z úplného vyražení báze, se rozpoznává AP endonukleázou, která vytváří zářez do poškozeného řetězce a otevírá jej pro další zpracování. Při opravě jednoduchého zlomu i při opravě excize báze polymerázy následně vkládají jeden či více nových nukleotidů a uzavírají poškozené místo, což vše opět vyžaduje řadu dalších proteinů.
|