| 1.3.1 Charakteristika ionizujГӯcГӯho zГЎЕҷenГӯ |
|
IonizujГӯcГӯ zГЎЕҷenГӯ je tok hmotnГҪch ДҚГЎstic nebo fotonЕҜ elektromagnetickГ©ho zГЎЕҷenГӯ, kterГ© majГӯ schopnost ionizovat atomy prostЕҷedГӯ nebo excitovat jejich jГЎdra. VznikГЎ jako prЕҜvodnГӯ jev jadernГҪch procesЕҜ (u rentgenovГ©ho zГЎЕҷenГӯ procesЕҜ odehrГЎvajГӯcГӯch se v elektronovГ©m obalu atomЕҜ). PЕҷi tДӣchto procesech se dostГЎvГЎ jГЎdro (nebo obal) atomu do excitovanГ©ho stavu, stГЎvГЎ se energeticky nestabilnГӯ. StabilnГӯ stav zГӯskГЎ prГЎvДӣ vyzГЎЕҷenГӯm energie ve formДӣ ДҚГЎstic nebo fotonЕҜ elektromagnetickГ©ho zГЎЕҷenГӯ.
KorpuskulГЎrnГӯ ionizujГӯcГӯ zГЎЕҷenГӯ je charakterizovГЎno elektrickГҪm nГЎbojem, klidovou hmotnostГӯ a kinetickou energiГӯ. Podle hmotnosti dДӣlГӯme ДҚГЎstice na:
FotonovГ© ionizujГӯcГӯ zГЎЕҷenГӯ mГЎ duГЎlnГӯ charakter (mГЎ vlastnosti jak elektromagnetickГ©ho vlnДӣnГӯ, tak i vlastnosti ДҚГЎstic o nulovГ© hmotnosti). RozeznГЎvГЎme fotonovГ© zГЎЕҷenГӯ Оі a rentgenovГ© zГЎЕҷenГӯ. Z fyzikГЎlnГӯho hlediska jde v podstatДӣ o stejnГҪ typ zГЎЕҷenГӯ, rozdГӯl je ve vlnovГ© dГ©lce a v tom, Еҫe zГЎЕҷenГӯ Оі vznikГЎ v atomovГ©m jГЎdЕҷe (pЕҷirozenГЎ a umДӣlГЎ radioaktivita) a rentgenovГ© zГЎЕҷenГӯ vznikГЎ interakcГӯ elektronu z obalu s tДӣЕҫkГҪmi atomy v materiГЎlu anody (rentgenovГ© pЕҷГӯstroje, betatron, lineГЎrnГӯ urychlovaДҚ).
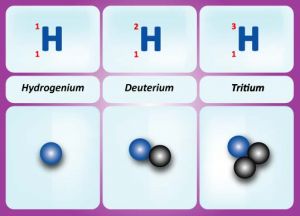
Vznik ionizujГӯcГӯho zГЎЕҷenГӯ souvisГӯ se strukturou atomЕҜ a atomovГҪch jader. Atomy vЕЎech lГЎtek se v principu sklГЎdajГӯ ze tЕҷГӯ druhЕҜ ДҚГЎstic - protonЕҜ, neutronЕҜ a elektronЕҜ. Protony a neutrony (spoleДҚnДӣ nazГҪvГЎme nukleony) tvoЕҷГӯ jГЎdro atomu. Elektrony obГӯhajГӯ kolem jГЎdra po vymezenГҪch drahГЎch. PoДҚet ДҚГЎstic v jГЎdЕҷe charakterizujГӯ nukleonovГ© (hmotnostnГӯ) a protonovГ© (atomovГ©) ДҚГӯslo. HmotnostnГӯ ДҚГӯslo A, udГЎvГЎ celkovГҪ poДҚet protonЕҜ a neutronЕҜ v jГЎdЕҷe. ProtonovГ© ДҚГӯslo Z udГЎvГЎ poДҚet protonЕҜ v jГЎdЕҷe (a tГӯm i poДҚet elektronЕҜ v obalu). Toto ДҚГӯslo udГЎvГЎ takГ© postavenГӯ prvku v MendДӣlejevovДӣ periodickГ©m systГ©mu, coЕҫ znamenГЎ, Еҫe prvek jednoznaДҚnДӣ identifikuje i z chemickГ©ho hlediska. RozdГӯl A - Z pak urДҚuje poДҚet neutronЕҜ v jГЎdЕҷe. HmotnostnГӯ ДҚГӯslo se pГӯЕЎe jako hornГӯ index pЕҷed chemickou znaДҚkou prvku, protonovГ© ДҚГӯslo jako dolnГӯ index ( Nuklidy se stejnГҪm poДҚtem protonЕҜ v jГЎdЕҷe nazГҪvГЎme izotopy. NapЕҷГӯklad izotopy vodГӯku jsou В Izotopy vodГӯku.
|